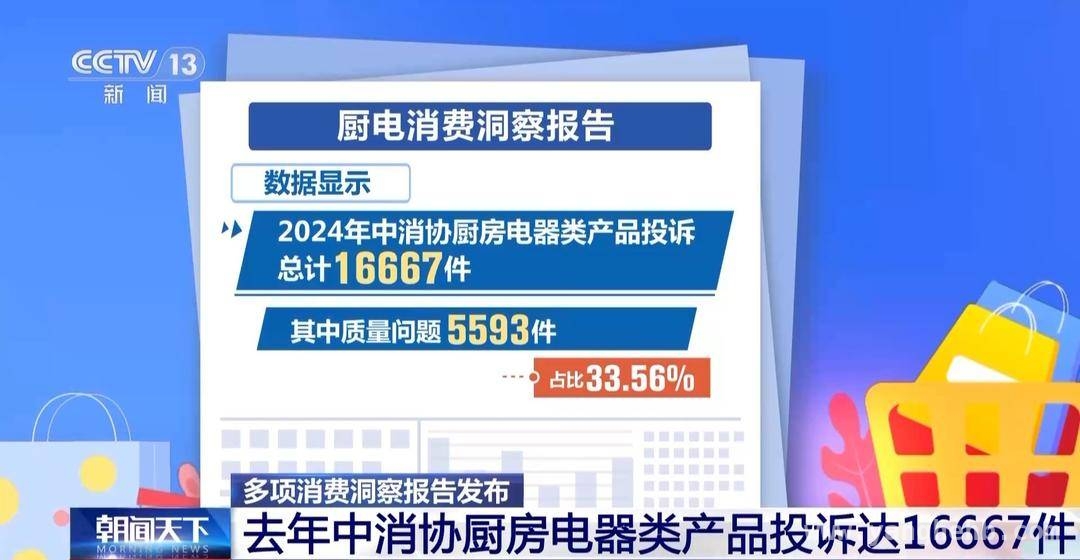
马克斯・普朗克生物化学研究所的研究人员与海德堡大学和耶鲁大学团队合作,发现了HIV生命周期中重要步骤背后的机制,即神秘的“间隔肽2”在将未成熟的HIV – 1颗粒转化为传染性颗粒方面起着关键作用,同时介绍了相关的研究过程和发现。
马克斯・普朗克生物化学研究所的科研人员取得了一项重大发现,他们揭开了HIV生命周期里一个关键步骤背后隐藏的机制。此次研究是与海德堡大学以及耶鲁大学的团队携手完成的,研究成果已经发表在了权威的《自然》杂志上。他们发现,病毒成分之一的神秘“间隔肽2”,在把未成熟的HIV – 1颗粒转变为具有传染性的颗粒这一过程中,起到了至关重要的作用。

HIV若要具备传染性,就必须经历一个成熟过程。在这个过程中,基质蛋白(红色)会发生重排。在未成熟的病毒颗粒中,基质蛋白呈现出松散的晶格结构(右上);而在成熟的HIV里,蛋白质间隔肽2的结合会触发新的、稳定的晶格形成(蓝色,右下)。(插图:Margot Riggi,生物化学MPI)
HIV – 1颗粒从受感染的细胞释放出来时,是以未成熟且无感染性的形式存在的。病毒颗粒的主要构建材料是大约2000个拷贝的长杆状蛋白质,名为Gag。为了获得传染性,HIV必须经历成熟过程,这一过程涉及到HIV – 1蛋白酶(一种病毒酶),它会将Gag切割成六个较小的蛋白质,其中包括衣壳蛋白和基质蛋白,从而导致病毒成分发生巨大的结构重排。
多年以来,科学家们一直致力于探索包裹基因组的病毒衣壳的结构变化。然而,对于病毒基质(包裹病毒的脂质膜正下方的蛋白质外壳),人们所知却非常有限。由马克斯・普朗克生物化学研究所所长兼结构生物学家约翰・布里格斯(John Briggs)带领的研究人员,如今已经弄清楚了基质蛋白在成熟过程中是如何重新排列成具有感染性的颗粒的。
科学家们运用最新的冷冻电子显微镜对病毒颗粒进行成像,随后通过计算图像分析,得出了病毒蛋白极为详细的3D模型。令人意想不到的是,他们发现基质的重排是由“间隔肽2”触发的。“间隔肽2”会粘附在基质上,使得基质以不同的方式堆积在一起。间隔肽2是切割Gag形成的六种成分中的一种,但其功能在此之前一直不为人知。间隔肽2与基质蛋白的结合,能够让病毒更快地与靶细胞融合。这项研究工作是与来自海德堡大学和美国耶鲁大学的合作伙伴共同开展的。
约翰・布里格斯解释道:“在我们的实验室里,2021年我们就已经获得了有关基质的第一个结构数据,但当时我们并不清楚是什么导致它在病毒成熟时重新排列。在这项新的研究中,我们制作出了更详细的矩阵层3D视图,这成为了我们了解其中奥秘的关键。”
该研究的两位第一作者詹姆斯・斯泰西(James Stacey)和多米尼克・赫比克(Dominik Hrebik)对他们的发现进行了解释。詹姆斯表示:“病毒基质在其成熟形式中有一个口袋。我们原本知道那里会有东西结合,但一直以为是来自膜的脂质。现在我们才发现,结合在那里的是间隔肽2。我们不禁思考,这个口袋未来是否能够成为药物分子的作用靶点。”多米尼克说:“到目前为止,间隔肽2的功能一直不清楚。多亏了高分辨率冷冻电子显微镜,我们现在已经看到这种肽在释放后会直接与基质蛋白结合,并且将成熟病毒中的蛋白质连接在一起。”
约翰・布里格斯总结道:“HIV – 1可能是被研究得最多的病毒,但在其复制过程中,我们仍然有一些重要步骤尚未完全了解。”
马克斯・普朗克生物化学研究所等团队合作研究发现,神秘的“间隔肽2”在HIV – 1颗粒从非感染性向传染性转化中起关键作用。研究人员通过冷冻电子显微镜和计算图像分析得出详细病毒蛋白3D模型,明确了基质蛋白重排机制,虽HIV – 1被广泛研究,但仍有复制步骤待解。
原创文章,作者:Weaver,如若转载,请注明出处:https://www.yanghehb.com/158.html